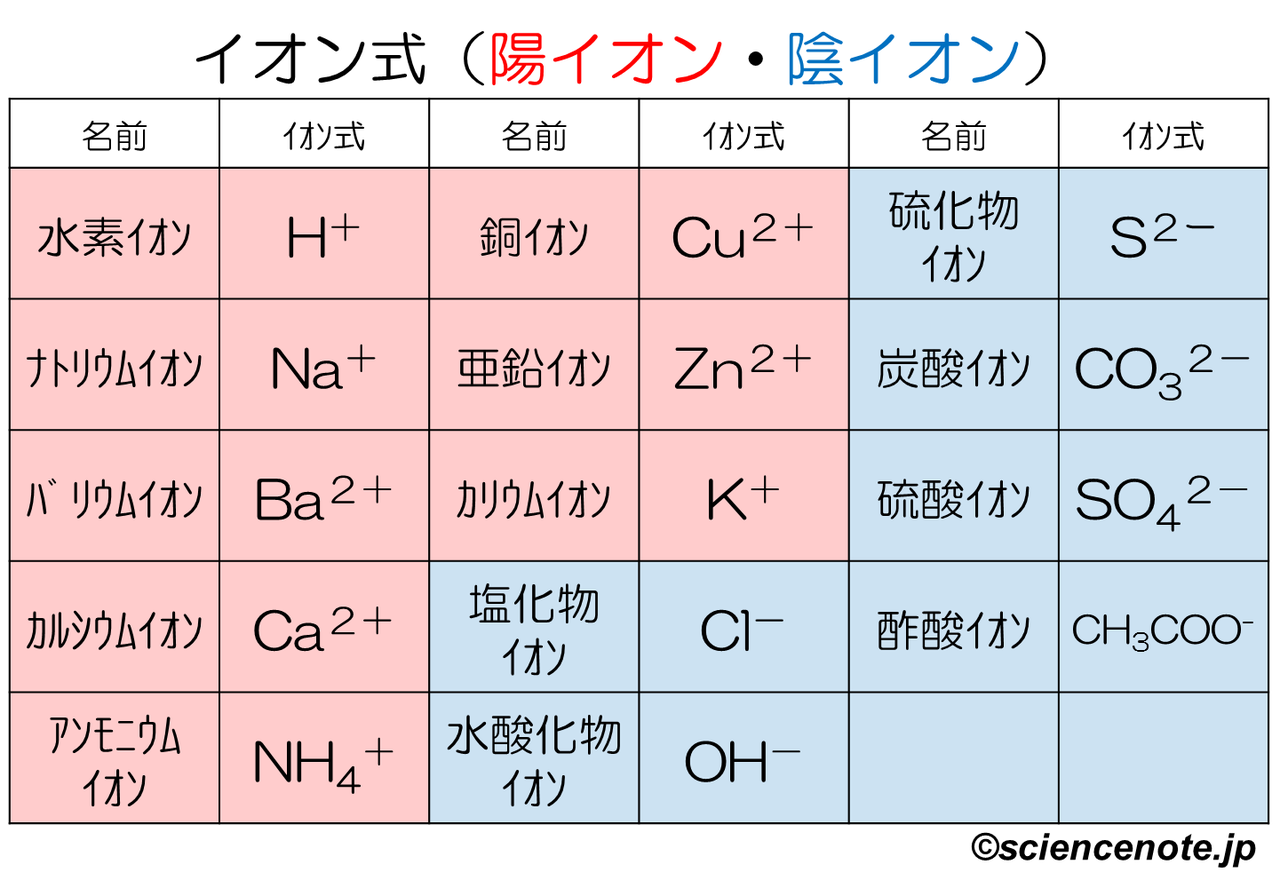
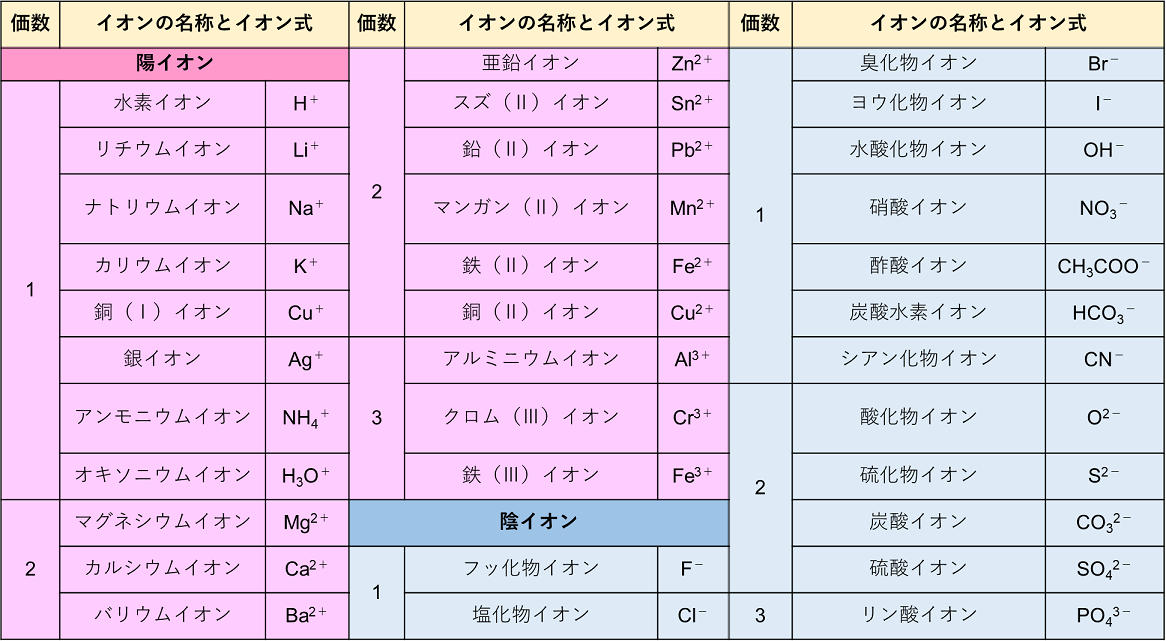
· 先に陽イオン→陰イオンの順で、 次に金属はアルファベット順、非金属は電気陰性度の弱い順、 とiupacとかで決められていた、って習いました。 水は単に電気陰性度順で h 2 o となります。 ただし、構造式を使う場合は、官能基単位で構造が分かる順にし2価 銅(Ⅱ)イオン Cu 2+ 亜鉛イオン Zn 2+ カドミウムイオン Cd 2+ スズ(Ⅱ)イオン Sn 2+ バリウムイオン Ba 2+ 鉛(Ⅱ)イオン Pb 2+ 3価 アルミニウムイオン Al 3+ クロム(Ⅲ)イオン Cr 3+ 鉄(Ⅲ)イオン Fe 3+ 4価 スズ(Ⅳ)イオン Sn 4+ 鉛(Ⅳ)イオン陽イオン\陰イオン Cl – 塩化物イオン OH – 水酸化物イオン O 2酸化物イオン SO 4 2硫酸イオン Na ナトリウムイオン NaCl � イオン の 組成 式 一覧
高校理論化学 イオン結合とイオン結晶 Nacl型 Cscl型構造 イオン限界半径比 受験の月
陽イオン 陰イオン 組成式 一覧
陽イオン 陰イオン 組成式 一覧-陰イオンと陽イオンの区別ができない場合 元素鉱物 (element mineral) 特定の陰イオンを含まない場合(金属など) 自然金(Au)、自然銀(Ag)、自然銅(Cu)、石墨(C)、自然硫黄(S)、など〔天然産であることを示すため『自然(native)』という語を陽イオン b.陰イオン C.まとめ 用語と補足説明 このページの参考となるサイト 戻る このページのトップへ 目次へ home 4.海水中の塩分の起源 a.陽イオン 海水中の陽イオンは、おもに河川が溶かし込んで運んできた陸の岩石がその起源である。下の表は「地球進化論」(岩波地球惑星




高校理論化学 その他のイオン結晶 Caf Sub 2 Sub 型 Zns型構造 受験の月
化学式 Wikipediaより引用 イオン結合 イオンになりやすい物質どおしは、陽イオンと陰イオンが電気的な力(静電気的に引力)で結びついている。 そのため、固体や液体の場合には、ひとつの物質として見出せないため、組成式で表す。組成式は陽イオン+陰イオンだと思いますが酢酸ナトリウムはなぜこのルールが効かないのでしょうか? 0 回答 まだ回答がありません。 この質問に回答する 似た質問 高校生 化学 無機化学に関する質問ですが。 気体や物質の生成時の反応物と生成物は覚えるのが普通ですか? 例) 銅硫酸 · 陽イオン・陰イオン 原子から電子が取れると 陽イオン に、原子が電子を取り込むと 陰イオン になる。 これらは、1コの原子からできたイオンなので 単原子イオン という。 陽イオン ナトリウムNaやカリウムKなどのアルカリ金属には、最外殻電子が1コ存在する。
<組成式> イオンからなる物質は、イオンの種類と、その数の割合を最も簡単な整数比で示した組成式で表される。 イオンからなる物質では、正・負の電荷がつり合い、全体として中性になっているので、次式が成り立つ。 陽イオンの正電荷の総和=陰イオンの負電荷の総和 (陽イオンの · 組成式の問題で、塩化ナトリウムなどの無機物を扱うときには、化学式を与えられず、組成式を物質の名称から答えなければならない場合もあります。 よく用いられる陽イオンと陰イオンの一覧表を作って覚え、組み合わせ方を理解しておけば簡単に問題を解けるようになるでしょう。 よく登場するイオンとしては、次のようなものがあります。 陽イオンLi、Na1919 · 陽イオンと陰イオンが、静電気的な力で引き合う結合。 イオン結晶 陽イオンと陰イオンが、規則正しく並んでいる結晶。 ※イオン結晶の特徴 ①一般に融点が高い 塩化ナトリウムの融点は約800℃ ②硬いがもろい 規則的に配列しているため硬いが、力が加わり配列がずれると「」と「」に反発が起きて特定の面で割れる(へき開) ③個体では電気を通さないが
· 19年9月15日 年5月22日 中3化学 中3, 化学 中3化学 イオン式の一覧を中学生向けに作成 しました。 さっそくイオン式の一覧を下に載せますが、 その下にはさらに、 化学式やイオン式の確認と解説 や イオン式の練習問題 も作ったので、ぜひ勉強に活用してください! 陽イオン1403 · イオン式一覧 プロ講師解説このページでは『イオン式一覧』について解説しています。解説は高校化学・化学基礎を扱うウェブメディア『化学のグルメ』を通じて6年間大学受験に携わるプロの化学講師が執筆します。 Recipes 基本的なイオン;イオンクロマトグラフィー担体 sca, sckシリーズ カタログ番号 製品名 包装量(g) 基体組成 官能基 対イオン 粒径(μm) イオン交換容量(meq/g) 主な用途;



スマホで危険物 学習帖 配位結合と特別なイオン F M サイエンスブログ



イオン結合とイオンからなる物質
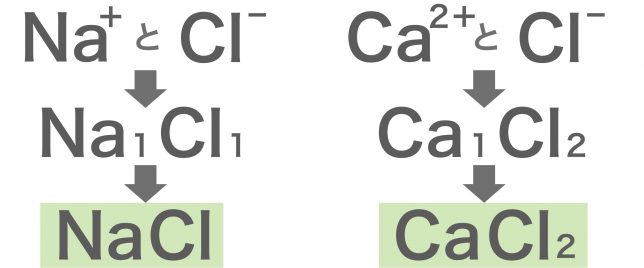
まずは、2つのイオンを陽イオン→陰イオンの順に並べます。 陽イオンはNa ,陰イオンはClですね。 Na 、Clと書いておきます。イオン式 イオンを表すには元素記号の右上に+や−をつけて表す。 例 ナトリウムイオン・・・ ナトリウム原子(Na)から電子が1つ失われたのがナトリウムイオン (Na +) である。 電子1つ分プラスなので右肩には+。これを 1価の陽イオン という。 銅イオン・・・ 銅原子(Cu)から電子が2つ陽イオンと陰イオンの強い静電気力でできた結合をイオン結合といます。 原子は他の原子と化学結合をしていろいろな物質を構成します。 その結合の1つがイオン結合です。クーロン力でできるイオン結合とはいったいどのような仕組みでで 続きを読む




金属結合とは 例 特徴 金属結晶 立方格子 理系ラボ



高校化学のイオンの問題で 陽イオンと陰イオンの組み合わせができる Yahoo 知恵袋
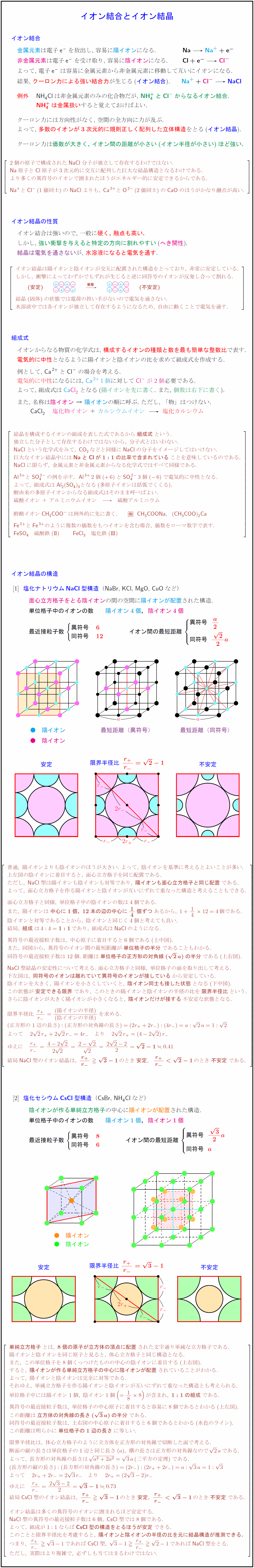
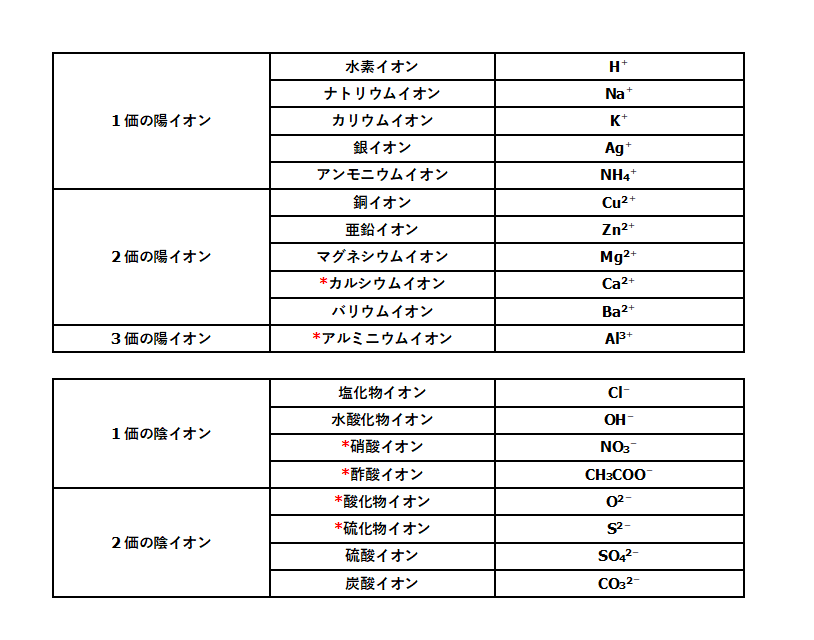
Na には「」とついているので、 「陽イオン」 となります。 一方、Cl を 塩化物イオン といいます。 Cl には、「」とついているので、 「陰イオン」 です。 · イオン結晶の組成式の書き方 ステップ1:イオンを陽イオン→陰イオンの順に並べる Na + Cl – ステップ2:陽・陰イオンの数の比を求める(電荷が0になるようにする) NaとClは1と1なので11で電荷が0になりますね。 · 21年03月06日 185中3理科 イオンの覚え方 ~秀英iD予備校映像教師ブログ~ 皆さん、こんにちは! 近藤です。 今回は中3理科の化学分野で、よく出てくる イオンの覚え方についてです! 1価の陽イオン H (+)(水素イオン) K (+)(カリウムイオン)



中3化学 イオンとは 中学理科 ポイントまとめと整理




組成式とは 分子式との違いも解説 一覧表つき 高校生向け受験応援メディア 受験のミカタ
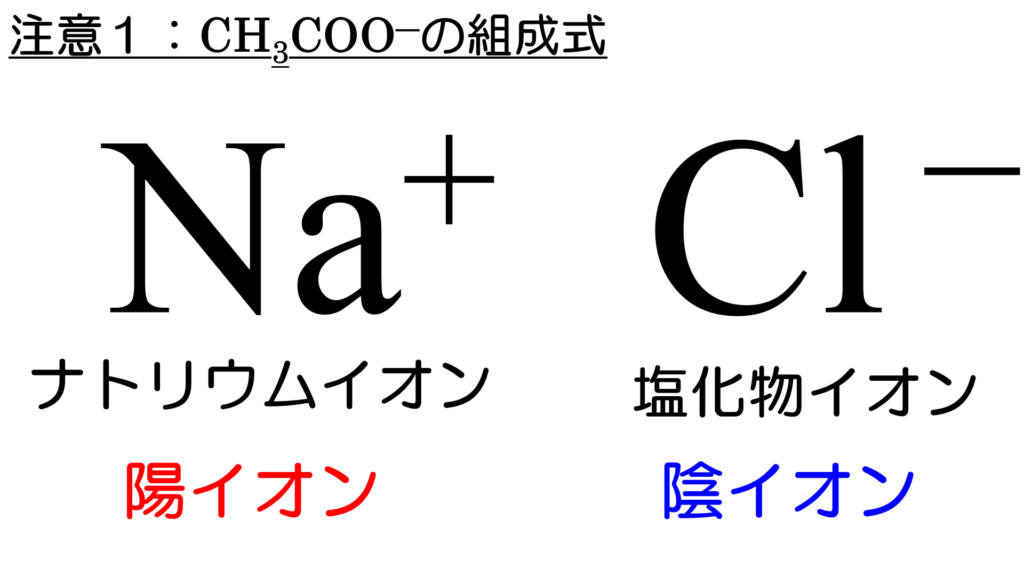
· 例えば ①塩→酸+塩基 ②塩→塩基+酸 ③a→陰イオン+陽イオン ④a→陽イオン+陰イオン ①と②、③と④、それぞれどちらの方が好ましいでしょうか?イオン結合 陽イオンと陰イオンとが静電気力(クーロン力)により結びついた結合。ふつう,金属 元素と非金属元素どうしの結合はイオン結合であることが多い。 塩化ナトリウムNaCl ナトリウムイオンNaと塩化物イオンClとがその静電気力により結びついている。 イオン結合によりできている · 塩化ナトリウム 陽イオン:Na 陰イオン:Cl 組成式:NaCl 塩化カルシウム 陽イオン:Ca2 陰イオン:Cl 組成式:CaCl2 塩化鉄(Ⅱ) 陽イオン:Fe2 陰イオン:Cl 組成式:FeCl2 塩化鉄(Ⅲ) 陽イオン:Fe3 陰イオン:Cl 組成式:FeCl3 水酸化カリウム 陽イオン:K 陰イオン:OH 組成式:KOH 酸化カルシウム 陽イオン:Ca2 陰イオン:O2 組成式:CaO 硝酸亜鉛 陽イオン



組成式の作り方について プラス マイナスのイオンの比で右上の数字が比 Yahoo 知恵袋




高校化学基礎 単原子イオンと多原子イオン 映像授業のtry It トライイット
れます四 面体シートと八面体シートは陽イオン を幾つかの陰イオンが囲むことによりできる多面 体がつながった構造をとります二 次元的な周期 a,bは それぞれ約52,9OAで す両 シートと AlO 175A SiO 162A 四面体シートを作る陽イオンのイオン半径 Fe3064,Al31503 · イオン結晶は、たくさんの陽イオンと陰イオンが結びついてできており、何個ずつ結びついているかはものによります。 なので、イオン結晶を表す化学式は、陽イオンと陰イオンがどのくらいの割合で結びついているか、その割合を最も簡単な整数比で表した式、 組成式 で表します。この物質の組成式、陽イオン、陰イオンをそれぞれ教えてください。 全部じゃなくても大丈夫です。 お願いします🙇♂️🙇♂️ 塩化ナトリウム 塩化カルシウム 塩化アンモニウム 塩化鉄 (中) 酸化鉄 (四) 硫酸鉄 (TI) 硫化鉄 (T) 酸化ナトリウム 酸化



陽イオン変性デンプン及び陰イオン性界面活性剤系を含むパーソナルケア組成物




2 の塩の組成式がどうして陰イオン 陽イオンの順番になっているんですか 教えてくだ Clear
アンモニウムイオンは,nh 4 ・・・1価の陽イオン。 硫酸イオンは,so 4 2・・・2価の陰イオンである。 ☆ ここで書き並べたものは,すべてイオン反応式(イオン同士の結合の様子を式にしたもの)である。実際の化学反応式とは異なるものが多い。組成式 暗記するのではなく,陽イオンと陰イオンの電荷の和がゼロになる数の比で組み合わせて 作れるようにしましょう。 <塩化物> 塩化ナトリウム NaCl 塩化カリウム KCl 塩化マグネシウム MgCl2 塩化カルシウム CaCl2 塩化バリウム BaCl2 塩化アルミニウム AlCl3陽イオンと陰イオン 陽イオンと自由電子 化学式 組成式 組成式 結合の種類 イオン結合 金属結合 硬さ 硬いがもろい 硬いものも軟らかいものもある 沸点・融点 高い 高いものも低いものもある (タングステンは3400℃。Hgは常温常圧で液体) 電気伝導
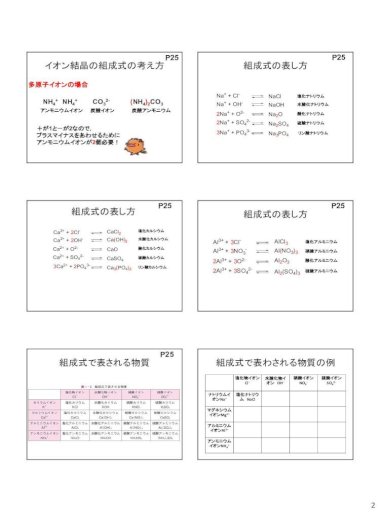



2cl Kubo Pdf Chem5 Pdfca2 2cl Cacl 2 陽イオン 価数数 陰イオン 価数数 P25 2 イオン結晶の組成式の考え方 Nh4 Nh 4 多原子イオンの場合 Co3 2 Nh




解き方が分からないです Clear
Sck01 5 st/dvb rso 3h 11 25 陽イオン分析 10 sca04 5 hma qa cl5 30 陰イオン分析 10溶離液組成が測定対象イオンの保持におよぼす影響 溶離液の組成の変化によっても、分析対象イオンの保持 挙動が変化することが知られています。 図2 は陰イオン分析用カラムIonPac AS12Aを用い、溶 離液中の炭酸水素ナトリウム(NaHCO 3)の濃度を03 mmol/L一定とし、炭酸ナトリウム(Na 2CO 3




化学基礎 イオン式




化学基礎模試解説 Kumonotaira




高校化学基礎 物質の構成 テスト6 第1問 問題編1 映像授業のtry It トライイット




Div Descubre Como Resolverlo En Qanda



化学 科学 Pararinpoppin In Hell




イオンの組成式についてなんですけど 右下の硫酸アルミニウムで なぜ3 2 2 3にな Clear
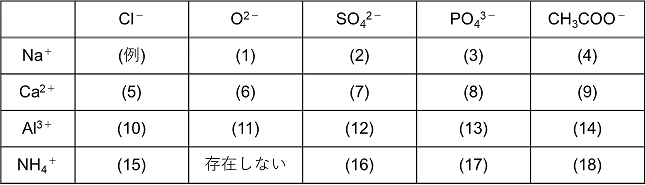



イオン結合とイオンからなる物質
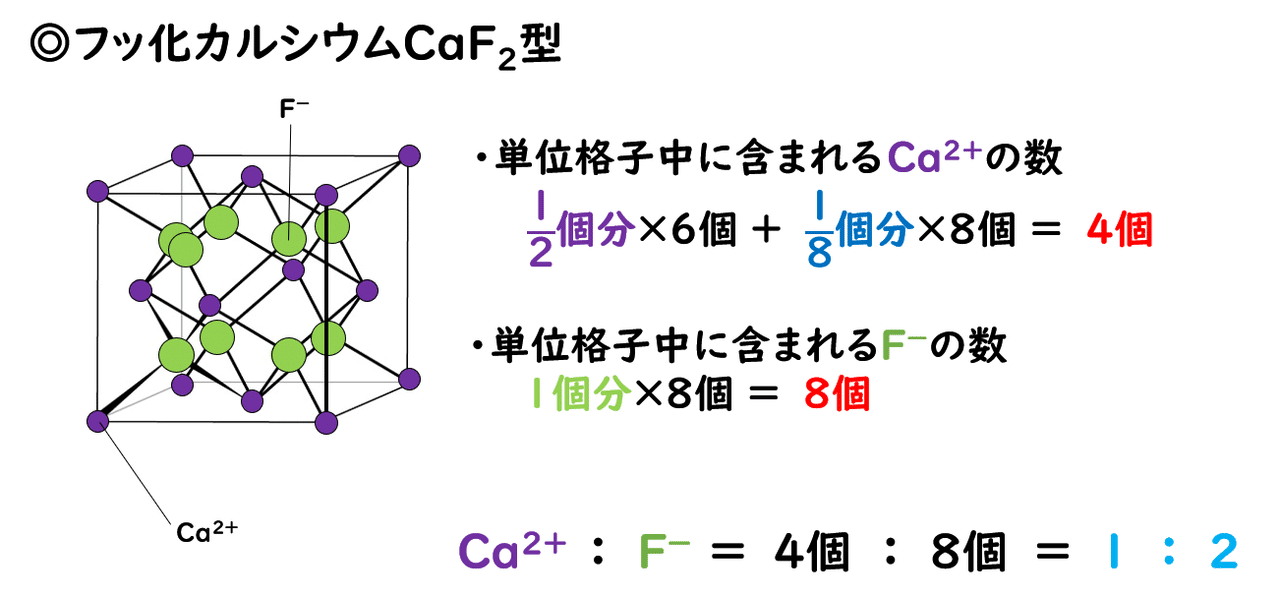



1 3 イオン結晶の構造 おのれー Note



酸化 物 イオン イオン 式



化学基礎の組成式なんですけど あってますか 赤と黒の違いは気 Yahoo 知恵袋




2 2 3 電離平衡
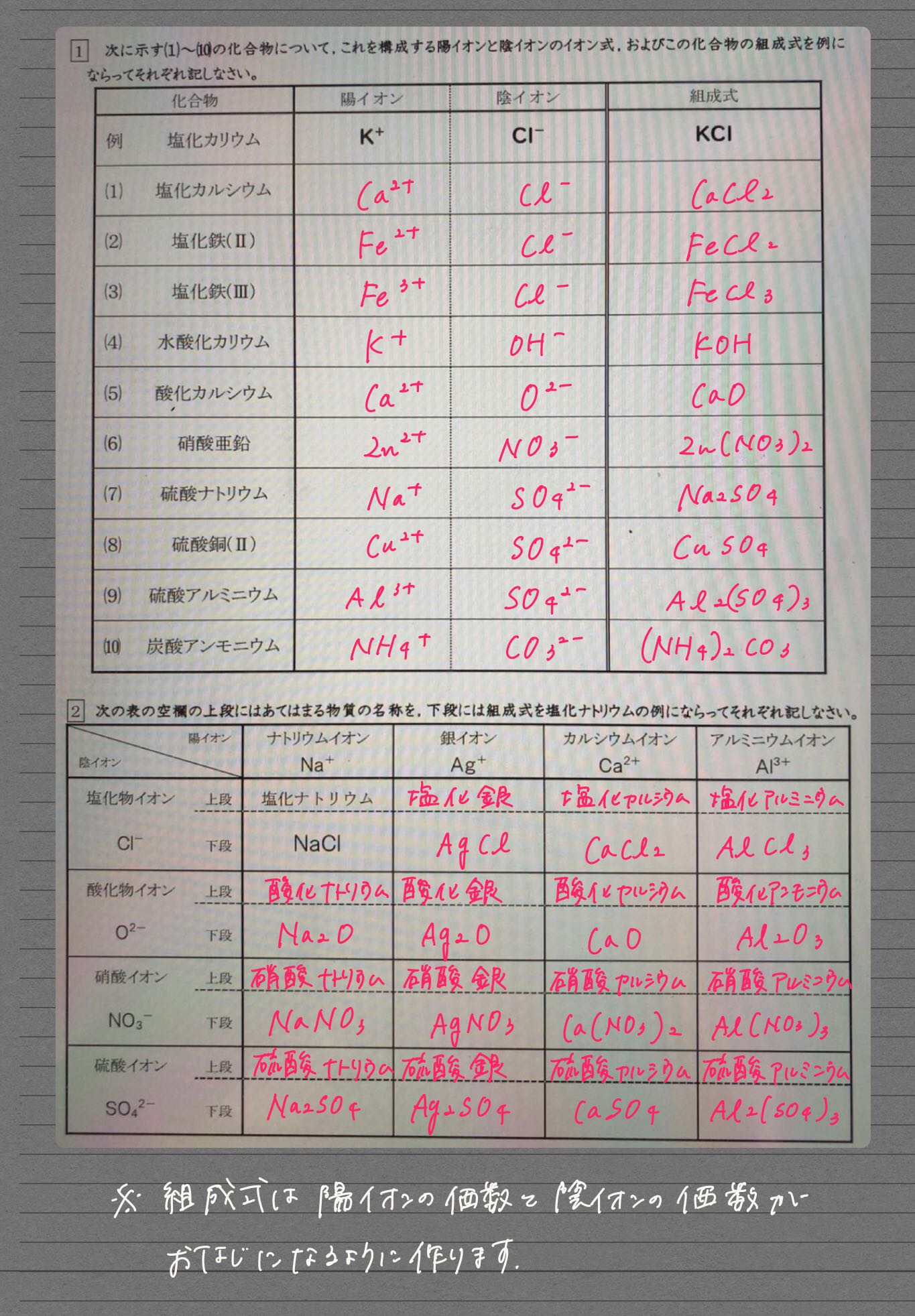



1 1 10 K C1 Kc1 Ii Descubre Como Resolverlo En Qanda




イオン結合でできるイオン結晶を表す組成式って何



高校化学のイオンの問題で 陽イオンと陰イオンの組み合わせができる Yahoo 知恵袋




高校理論化学 その他のイオン結晶 Caf Sub 2 Sub 型 Zns型構造 受験の月



高校化学のイオンの問題で 陽イオンと陰イオンの組み合わせができる Yahoo 知恵袋




化学基礎 イオン結合の組成式 その3 よく間違えるところ




組成式は がつくものは何を表しているのですか Clear




組成 式 一覧 ガラスの種類と組成 ガラスの基礎知識 国内大手加工ガラスメーカーのガラス情報専門サイト 三芝硝材




イオン結合とイオン結晶
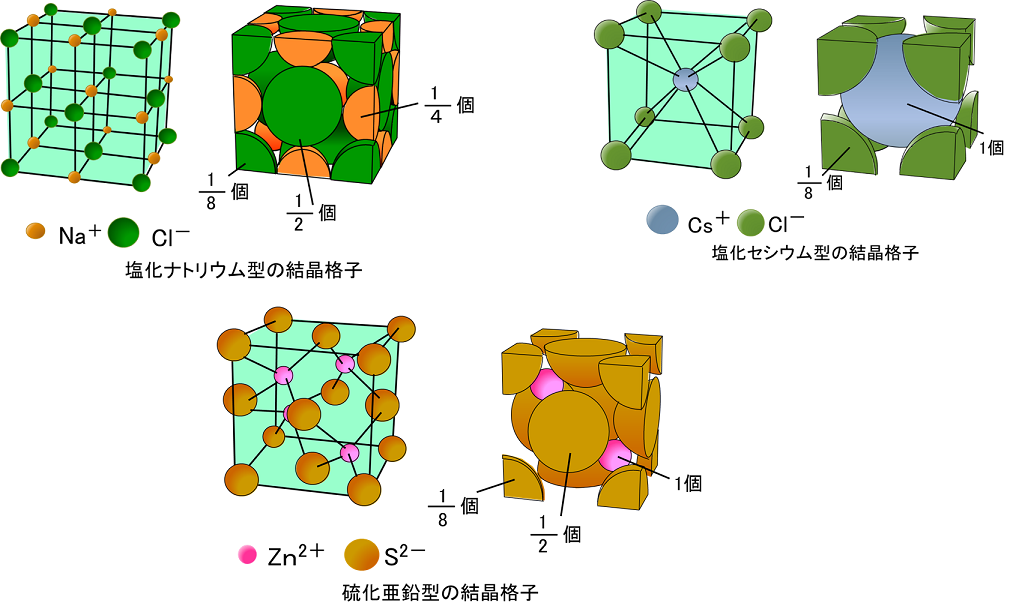



イオン結合とイオンからなる物質



酸化 物 イオン イオン 式




イオン式 分類 単原子イオン 多原子イオン Chemihack おうちで学べる化学



受験基礎化学 15 化学結合のまとめ みかみの参考書ブログ




高校化学基礎 組成式の書き方 映像授業のtry It トライイット




化学基礎 高1 物質の構成 原子の構造 イオン 高校生 化学のノート Clear 化学 化学結合 ノート 表紙



イオン結合と結晶




高校理論化学 イオン結合とイオン結晶 Nacl型 Cscl型構造 イオン限界半径比 受験の月



イオン結合とは何か 組成式や名称の書き方は 高校化学をスキマ時間でわかりやすく




イオン結合とは 例 結晶 共有結合との違い 半径 理系ラボ
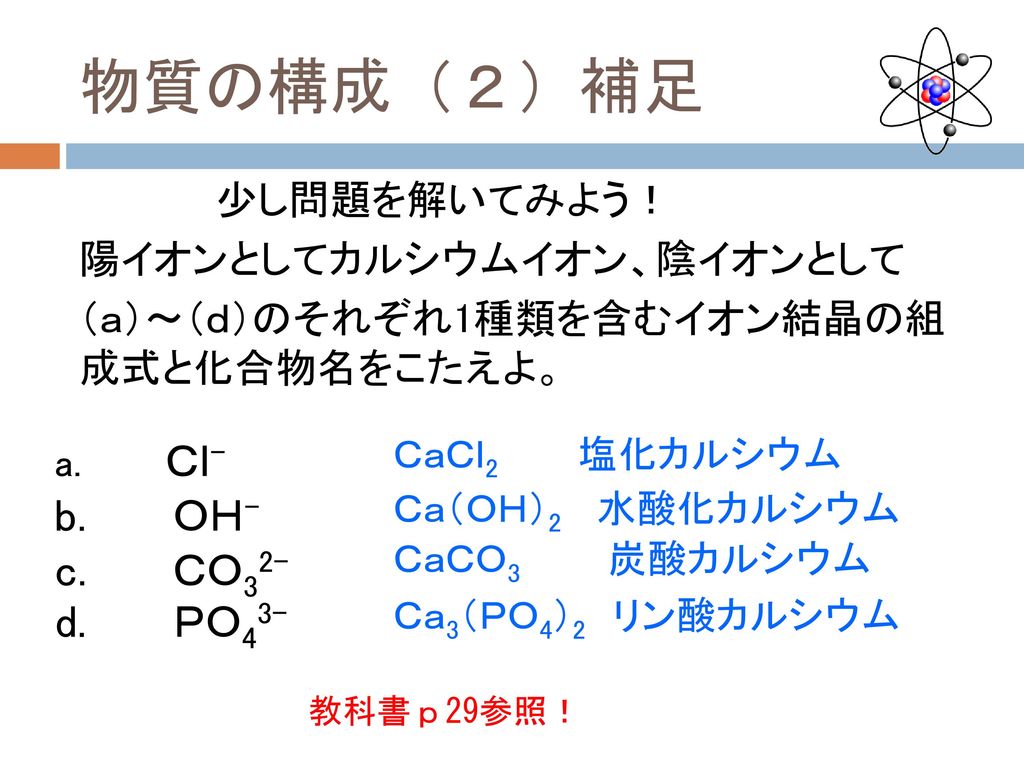



教養の化学 第5週 13年10月21日 担当 杉本昭子 Ppt Download
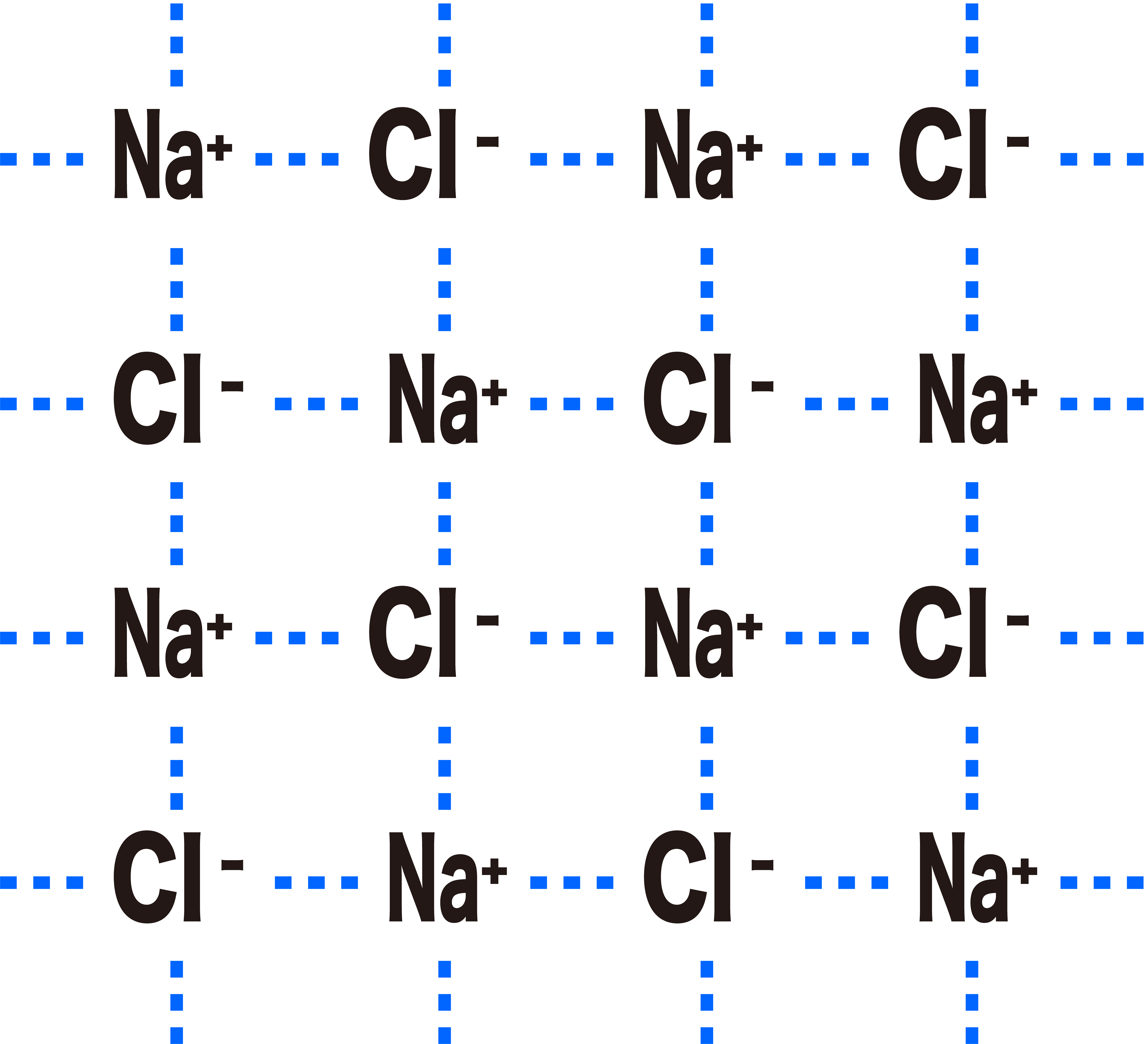



イオン結合 例 共有結合との違い 特徴 強さなど 化学のグルメ




高校化学 ファンデルワールス力 充填率 組成式と分子式を簡単に解説 高校化学選択をしている受験生や高校生は必見 弁理士を目指すブログ



イオン式の覚え方みたいなのってありますか これ全て覚えたいのですが Yahoo 知恵袋




組成 式 一覧 ガラスの種類と組成 ガラスの基礎知識 国内大手加工ガラスメーカーのガラス情報専門サイト 三芝硝材




なぜ結合しないんですか 大至急お願いします Clear
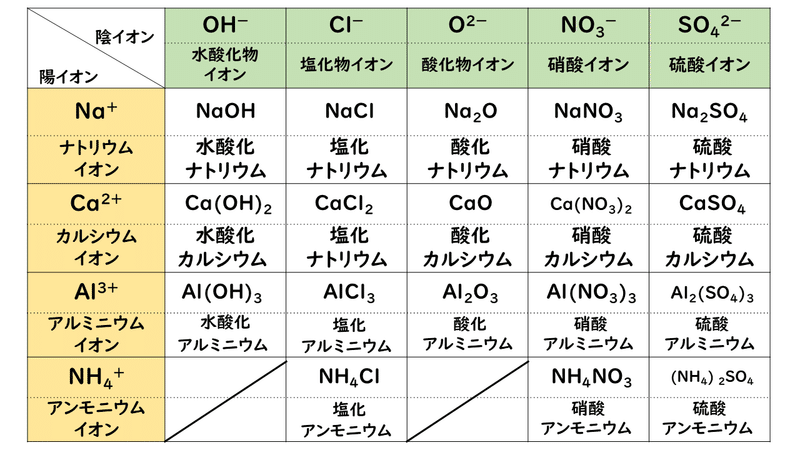



3 1 イオン結合とイオン結晶 おのれー Note




トップ 100 硝酸 カルシウム 組成 式 Minecraftの最高のアイデア
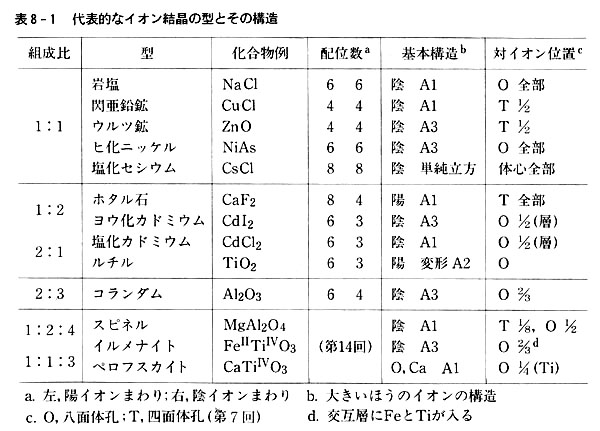



第8章 イオン結晶
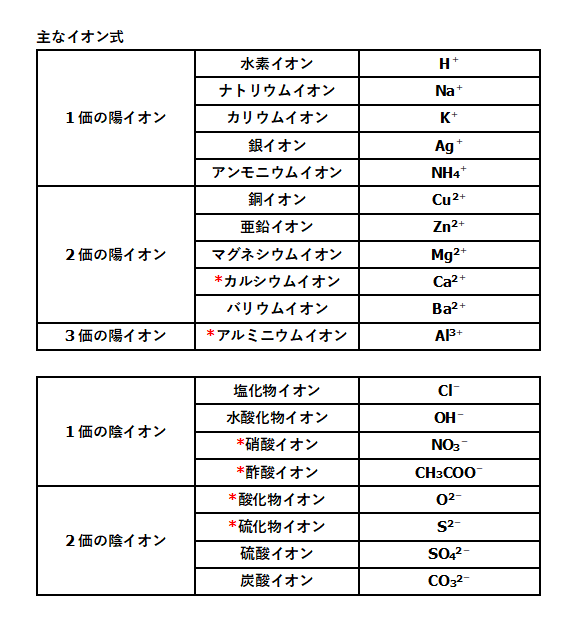



イオン式 電離式まとめ 中学理科 ポイントまとめと整理




この物質の組成式 陽イオン 陰イオンをそれぞれ教えてください 全部じゃなくても大丈夫 Clear
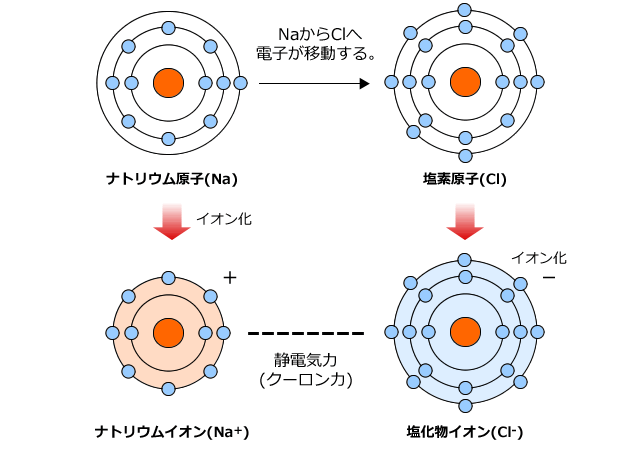



化学講座 第10回 イオン結合とイオン性物質 金属結合と金属結晶 私立 国公立大学医学部に入ろう ドットコム



山崎高校 化学 授業支援システム




高校 化学基礎 要点整理 化学結合 2




危険物資格取得のための高校化学no 10 組成式 F M サイエンスブログ




イオン結合とは 例 結晶 共有結合との違い 半径 理系ラボ
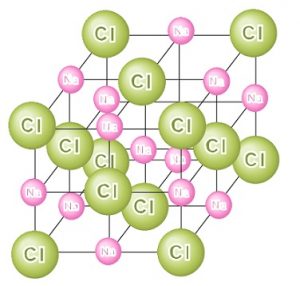



イオン結合でできるイオン結晶を表す組成式って何
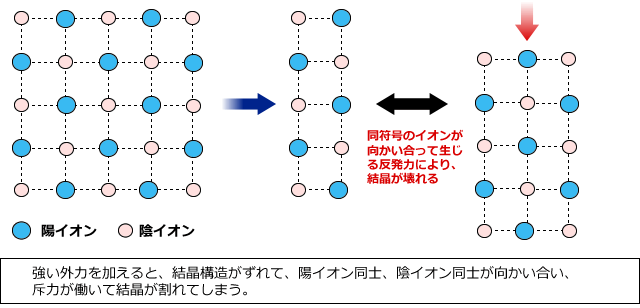



化学講座 第10回 イオン結合とイオン性物質 金属結合と金属結晶 私立 国公立大学医学部に入ろう ドットコム




組成式とは 分子式との違いも解説 一覧表つき 高校生向け受験応援メディア 受験のミカタ
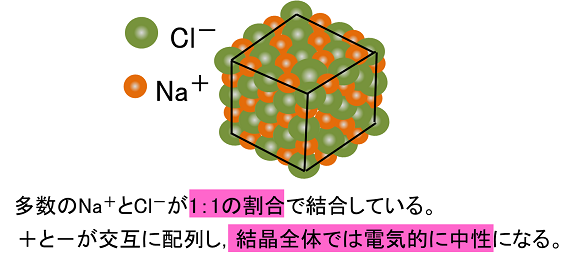



イオン結合とイオンからなる物質




完全版 イオン結晶 金属結晶 分子結晶 共有結晶の違いをアニメーション解説 練習問題で完璧に サイエンスストック 高校化学をアニメーションで理解する
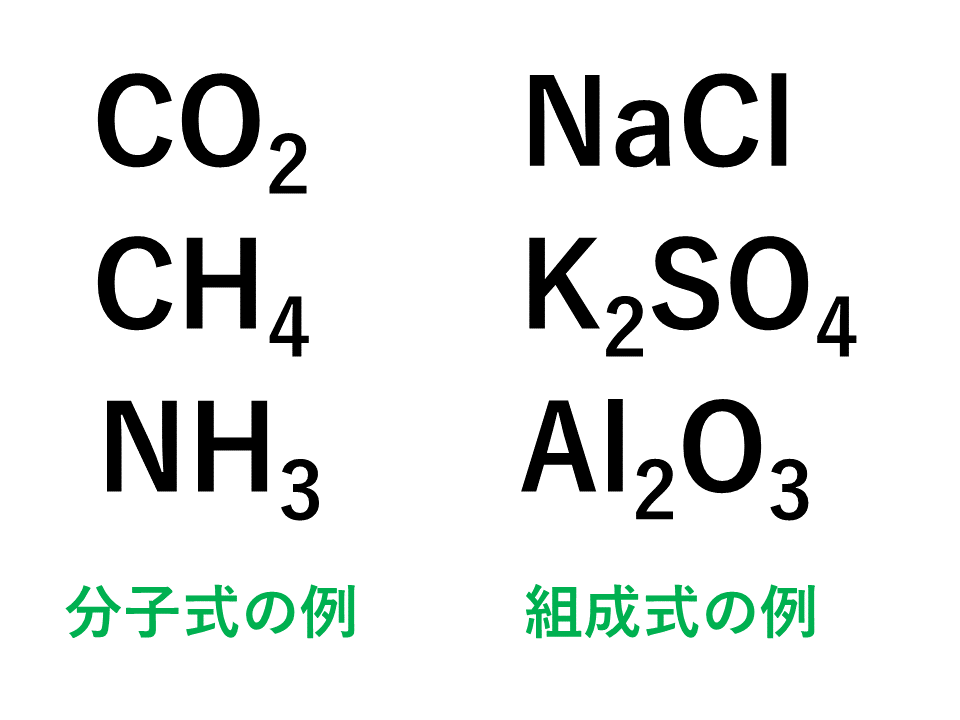



5分でわかる イオン結合とは 共有結合との違いと組成式 分子式を図で徹底解説 サイエンスストック 高校化学をアニメーションで理解する




組成 式 一覧 ガラスの種類と組成 ガラスの基礎知識 国内大手加工ガラスメーカーのガラス情報専門サイト 三芝硝材




組成 式 一覧 ガラスの種類と組成 ガラスの基礎知識 国内大手加工ガラスメーカーのガラス情報専門サイト 三芝硝材



イオン結合とイオンからなる物質 化学コラム




高校化学基礎 単原子イオンと多原子イオン 映像授業のtry It トライイット




イオン式 電離式まとめ 中学理科 ポイントまとめと整理




トップ 100 硝酸 カルシウム 組成 式 Minecraftの最高のアイデア




1 1 6 Descubre Como Resolverlo En Qanda
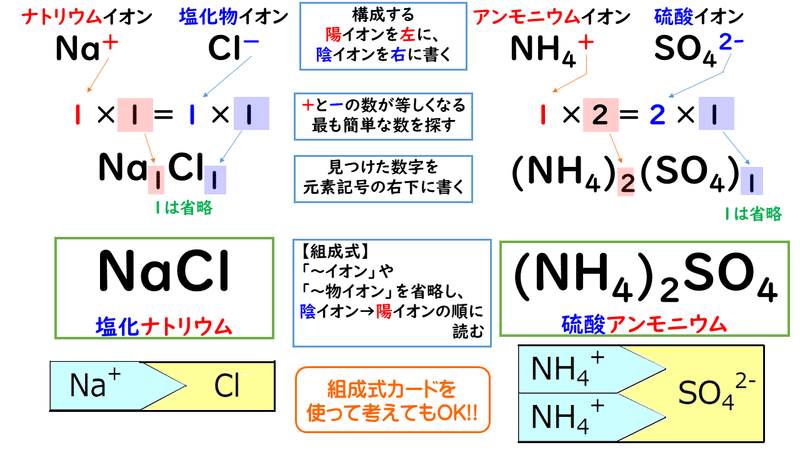



3 1 イオン結合とイオン結晶 おのれー Note



化学反応式の書き方
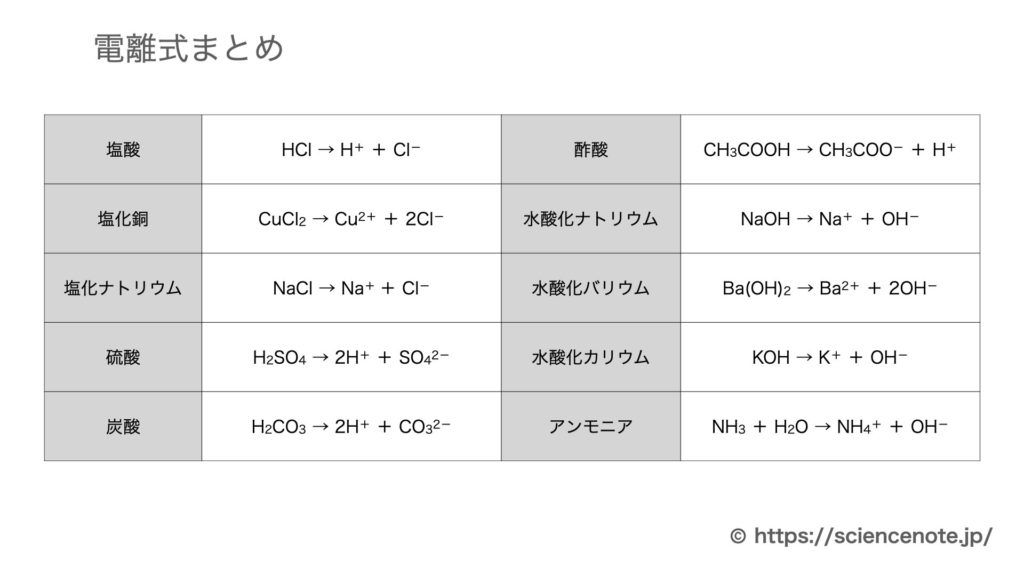



電離とは 電離式まとめ10選 中学化学 Sciencenote Jp




分子式 一覧 化学式とは 受験化学で覚えておくべき化学式を一覧にまとめてみた




高校化学基礎 組成式 練習編 映像授業のtry It トライイット
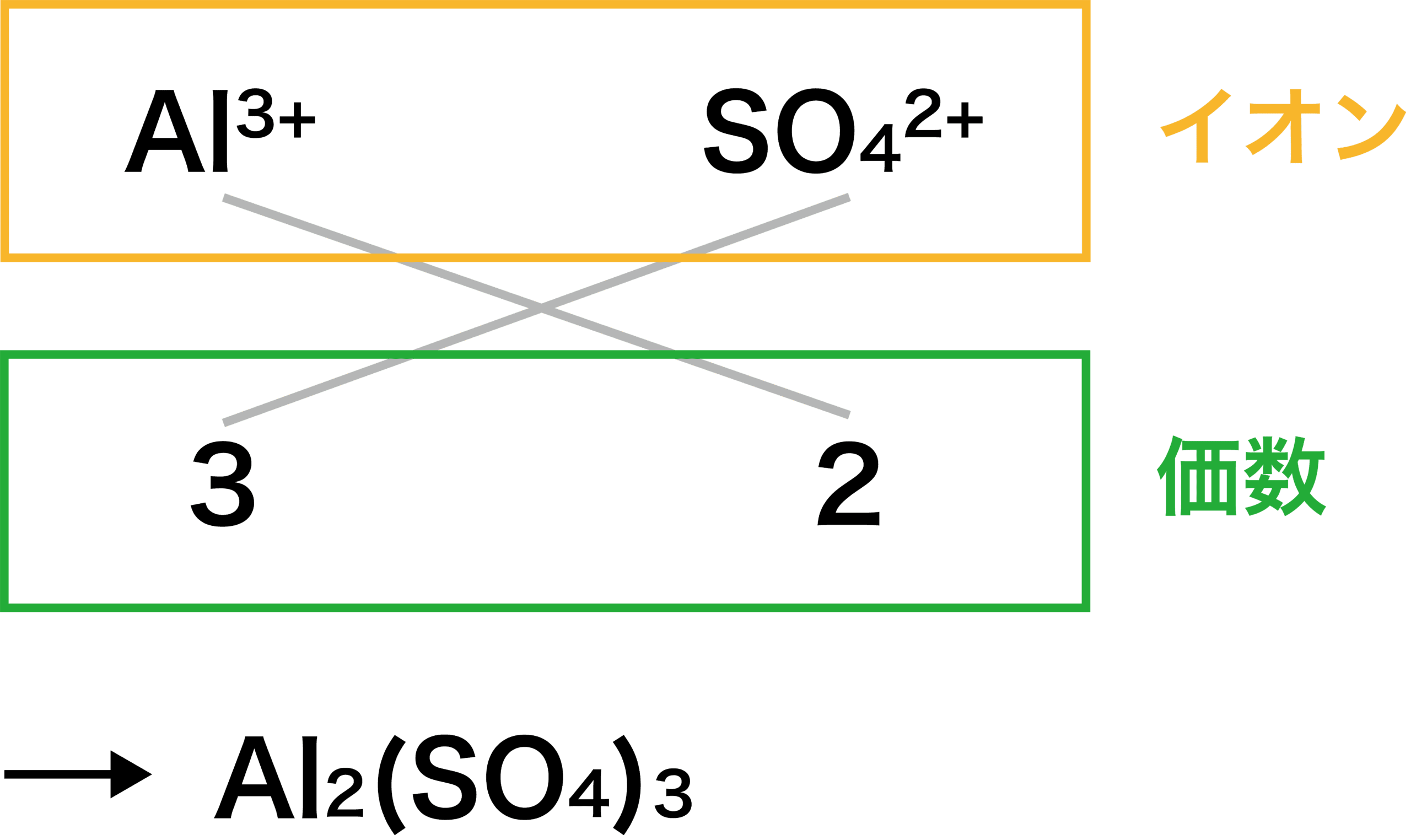



イオン結合 例 共有結合との違い 特徴 強さなど 化学のグルメ



イオン結合の組み合わせ理科の講義ノート Lecture Notebook




高校化学 結合 イオン結合 組成式の書き方 オンライン無料塾 ターンナップ
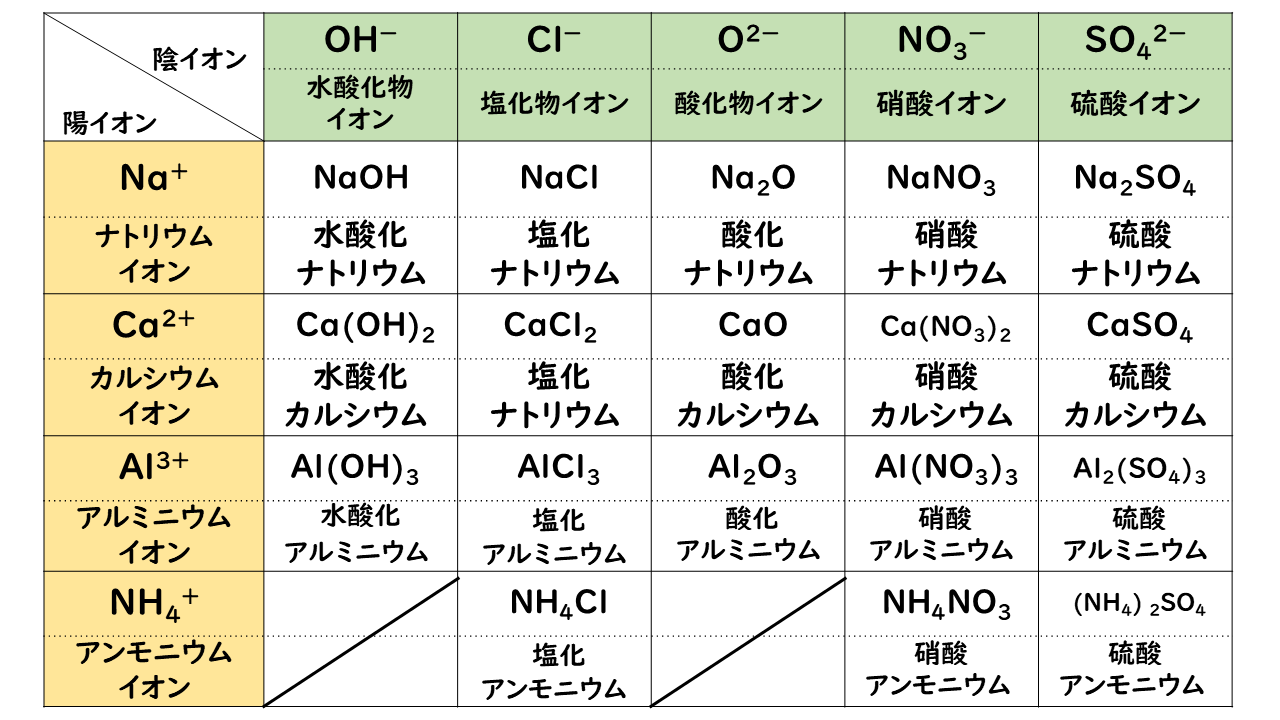



最高 マグネシウム 化学式
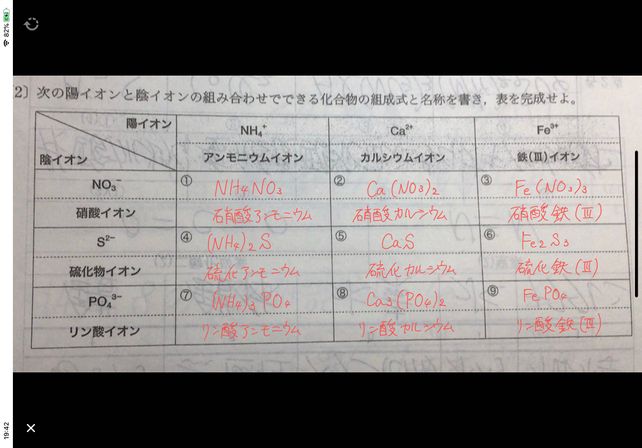



Left 2right 9 To Nh C Descubre Como Resolverlo En Qanda




日本石鹸洗剤工業会 石けん洗剤知識
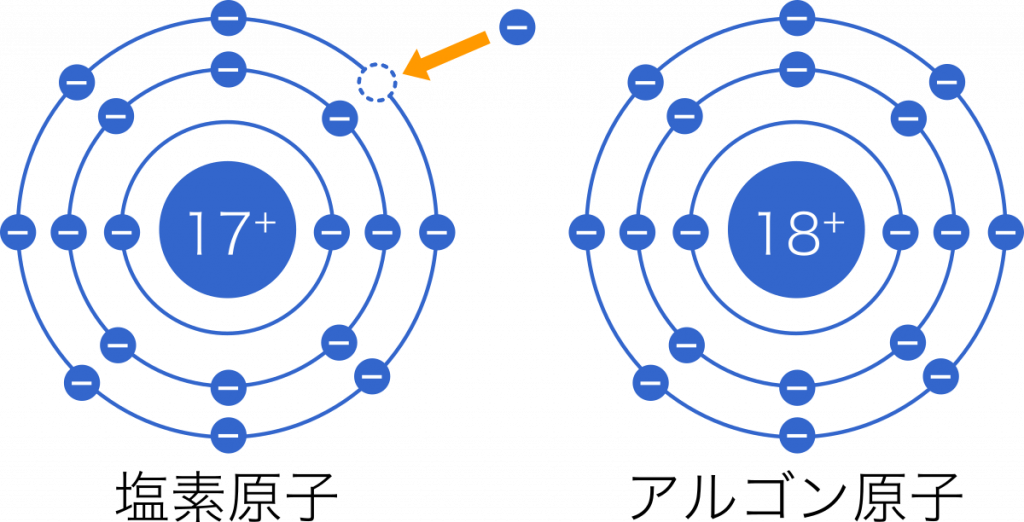



高校化学基礎まとめ イオン Mm参考書




ボード 解剖学 のピン




組成式とは 入試で必要な知識と勘違いするポイントをまとめてみた 化学受験テクニック塾



組成 式 一覧 ガラスの種類と組成 ガラスの基礎知識 国内大手加工ガラスメーカーのガラス情報専門サイト 三芝硝材




化学反応式の書き方について 理科 苦手解決q A 進研ゼミ高校講座




イオン結合とイオンからなる物質




Descubre Como Resolverlo En Qanda




について質問です Clear



0 件のコメント:
コメントを投稿